Definisi Laju Reaksi
Laju reaksi rerata analog dengan kecepatan rerata mobil. Jika posisi rerata mobil dicatat pada dua waktu yang berbeda, maka :
Dengan cara yang sama, laju reaksi rerata diperoleh dengan membagi perubahan konsentrasi reaktan atau produk dengan interval waktu terjadinya reaksi :
Jika konsentrasi diukur dalam mol L-1 dan waktu dalam detik, maka laju reaksi mempunyai satuan mol L-1s-1. Kita ambil contoh khusus. Dalam reaksi fasa gas
NO2 dan CO dikonsumsi pada saat pembentukan NO dan CO2. Jika sebuah kuar dapat mengukur konsentrasi NO, laju reaksi rerata dapat diperkirakan dari nisbah perubahan konsentrasi NO, ∆[NO] terhadap interval waktu, ∆t:
Jadi laju reaksi adalah besarnya perubahan konsentrasi reaktan atau produk dalam satu satuan waktu. Perubahan laju konsentrasi setiap unsur dibagi dengan koefisiennya dalam persamaan yang seimbang/stoikiometri. Laju perubahan reaktan muncul dengan tanda negatif dan laju perubahan produk dengan tanda positif.
Untuk reaksi yang umum:
aA + bB → cC + dD
Lajunya ialah
Hubungan ini benar selama tidak ada unsur antara atau jika konsentrasinya bergantung pada waktu di sepanjang waktu reaksi.
Menentukan Laju Reaksi :
Perhatikan penguraian nitrogen dioksida, NO2 menjadi nitrogen oksida, NO dan oksigen, O2 : 2NO2 → 2NO + O2
a. Tulislah pernyataan untuk laju rata-rata berkurangnya konsentrasi NO2 dan laju rata-rata bertambahnya konsentrasi NO dan O2.
b. Jika laju rata-rata berkurangnya konsentrasi NO2 ditetapkan dan dijumpai sebesar 4×10-13mol L-1s-1, berapakah laju rata-rata padanannya (dari) bertambahnya konsentrasi NO dan O2
Jawaban :
a. Laju rata-rata berkurangnya konsentrasi NO2 dinyatakan sebagai :
Laju rata-rata bertambahnya konsentrasi NO dan O2 dinyatakan sebagai:
b. Untuk tiap dua molekul NO2 yang bereaksi terbentuk dua molekul NO. Jadi berkurangnya konsentrasi NO2 dan bertambahnya konsentrasi NO berlangsung dengan laju yang sama
Hukum Laju
Dalam membahas reaksi kesetimbangan kimia telah ditekankan bahwa reaksi ke kanan maupun ke kiri dapat terjadi begitu produk terbentuk, produk ini dapat bereaksi kembali menghasilkan reaktan semula.
Laju bersih ialah:
Laju bersih = laju ke kanan – laju ke kiri
Dapat dikatakan, pengukuran konsentrasi memberikan laju bersih, bukannya sekedar laju ke kanan. Bagaimanapun, sesaat sebelum reaksi yang dimulai dari reaktan murni, konsentrasi reaktan jauh lebih tinggi dibandingkan produknya sehingga laju ke kiri dapat diabaikan. Selain itu, banyak reaksi berlangsung sempurna (K>>1) sehingga laju yang terukur hanyalah reaksi ke kanan atau eksperimen dapat diatur agar produknya dapat dialihkan jika terbentuk. Dalam subbab ini, persamaan diberikan pada laju ke kanan saja.
Faktor-faktor yang mempengaruhi kecepatan reaksi
- Kecepatan Reaksi dipengaruhi oleh ukuran partikel/zat.
Semakin luas permukaan maka semakin banyak tempat bersentuhan untuk berlangsungnya reaksi. Luas permukaan zat dapat dicapai dengan cara memperkecil ukuran zat tersebut - Kecepatan Reaksi dipengaruhi oleh suhu.
Semakin tinggi suhu reaksi, kecepatan reaksi juga akan makin meningkat sesuai dengan teori Arhenius. - Kecepatan Reaksi dipengaruhi oleh katalis.
Adanya katalisator dalam reaksi dapat mempercepat jalannya suatu reaksi. Kereakifan dari katalis bergantung dari jenis dan konsentrasi yang digunakan.
Katalis
Katalis adalah suatu zat yang mempercepat suatu laju reaksi, namun ia sendiri, secara kimiawi, tidak berubah pada akhir reaksi. Ketika reaksi selesai, maka akan didapatkan kembali massa katalasis yang sama seperti pada awal ditambahkan.
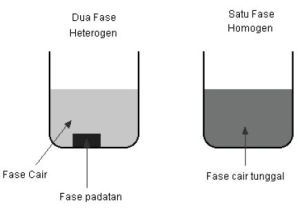
Katalis dapat dibagi berdasarkan dua tipe dasar, yaitu reaksi heterogen dan reaksi homogen. Didalam reaksi heterogen, katalis berada dalam fase yang berbeda dengan reaktan. Sedangkan pada dalam reaksi homogen, katalis berada dalam fase yang sama dengan reaktan.
Jika kita melihat suatu campuran dan dapat melihat suatu batas antara dua komponen, dua komponen itu berada dalam fase yang berbeda. Campuran antara padat dan cair terdiri dari dua fase. Campuran antara beberapa senyawa kimia dalam satu larutan terdiri hanya dari satu fase, karena kita tidak dapat melihat batas antara senyawa-senyawa kimia tersebut.
Fase berbeda denga istilah keadaan fisik (padat, cair dan gas). Fase dapat juga meliputi padat, cair dan gas, akan tetapi lebih sedikit luas. Fase juga dapat diterapkan dalam dua zat cair dimana keduanya tidak saling melarutkan (contoh, minyak dan air).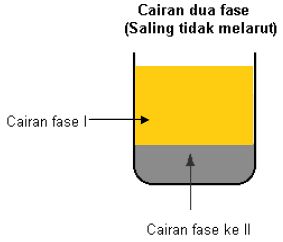

Energi Aktivasi
Tumbukan-tumbukan akan menghasilkan reaksi jika partikel-partikel bertumbukan dengan energi yang cukup untuk memulai suatu reaksi. Energi minimum yang diperlukan disebut dengan reaksi aktivasi energi. Kita dapat menggambarkan keadaan dari energi aktivasi pada distribusi Maxwell-Boltzmann seperti ini:
Orde Reaksi
Orde suatu reaksi ialah jumlah semua eksponen (dari konsentrasi dalam persamaan laju. Orde reaksi juga menyatakan besarnya pengaruh konsentrasi reaktan (pereaksi) terhadap laju reaksi.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan.
Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi :
v = k (A) (B) 2
persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3.
Contoh soal:
Dari reaksi 2NO(g) + Br2(g) → 2NOBr(g)
dibuat percobaan dan diperoleh data sebagai berikut:
| No. | (NO) mol/l | (Br2) mol/l | Kecepatan Reaksi mol / 1 / detik |
| 1. | 0.1 | 0.1 | 12 |
| 2. | 0.1 | 0.2 | 24 |
| 3. | 0.1 | 0.3 | 36 |
| 4. | 0.2 | 0.1 | 48 |
| 5. | 0.3 | 0.1 | 108 |
Pertanyaan:
a. Tentukan orde reaksinya !
b. Tentukan harga k (tetapan laju reaksi) !
b. Tentukan harga k (tetapan laju reaksi) !
Jawab:
a.Pertama-tama kita misalkan rumus kecepatan reaksinya adalah V = k(NO)x(Br2)y : jadi kita harus mencari nilai x den y.
Untuk menentukan nilai x maka kita ambil data dimana konsentrasi terhadap Br2 tidak berubah, yaitu data (1) dan (4).
Dari data ini terlihat konsentrasi NO naik 2 kali sedangkan kecepatan reaksinya naik 4 kali maka :
Untuk menentukan nilai x maka kita ambil data dimana konsentrasi terhadap Br2 tidak berubah, yaitu data (1) dan (4).
Dari data ini terlihat konsentrasi NO naik 2 kali sedangkan kecepatan reaksinya naik 4 kali maka :
2x = 4 → x = 2 (reaksi orde 2 terhadap NO)
Untuk menentukan nilai y maka kita ambil data dimana konsentrasi terhadap NO tidak berubah yaitu data (1) dan (2). Dari data ini terlihat konsentrasi Br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka :
2y = 2 → y = 1 (reaksi orde 1 terhadap Br2)
Jadi rumus kecepatan reaksinya : V = k(NO)2(Br2) (reaksi orde 3)
b.Untuk menentukan nilai k cukup kita ambil salah satu data percobaan saja misalnya data (1), maka:
V = k(NO)2(Br2)
12 = k(0.1)2(0.1)
12 = k(0.1)2(0.1)
k = 12 x 103 mol-212det-1
Jika laju suatu reaksi berbanding lurus dengan pangkat satu konsentrasi dari hanya satu pereaksi.
Laju = k [A]
Maka reaksi itu dikatakan sebagai reaksi orde pertama. Penguraian N2O5 merupakan suatu contoh reaksi orde pertama. Jika laju reaksi itu berbanding lurus dengan pangkat dua suatu pereaksi,
Laju = k[A]2
Atau berbanding lurus dengan pangkat satu konsentrasi dari dua pereaksi,
Laju = k [A][B]
Maka reaksi itu disebut reaksi orde kedua. Dapat juga disebut orde terhadap masing-masing pereaksi. Misalnya dalam persamaan terakhir itu adalah orde pertama dalam A dan orde dalam B, atau orde kedua secara keseluruhan. Suatu reaksi dapat berorde ketiga atau mungkin lebih tinggi lagi, tetapi hal-hal semacam itu sangat jarang. Dalam reaksi yang rumit, laju itu mungkin berorde pecahan, misalnya orde pertama dalam A dan orde 0,5 dalam B atau berorde 1,5 secara keseluruhan.
Suatu reaksi dapat tak tergantung pada konsentrasi suatu pereaksi. Perhatikan reaksi umum, yang ternyata berorde pertama dalam A. Jika kenaikan konsentrasi B tidak menaikkan laju reaksi, maka reaksi itu disebut orde nol terhadap B. Ini bisa diungkapkan sebagai :
Laju = k[A][B]0 = k[A]
Orde suatu reaksi tak dapat diperoleh dari koefisien pereaksi dalam persamaan berimbangnya. Dalam penguraian N2O5 dan NO2, koefisien untuk pereaksi dalam masing-masing persamaan berimbang adalah 2 tetapi reaksi pertama bersifat orde pertama dalam N2O5 dan yang kedua berorde kedua dalam NO2. Seperti dilukiskan oleh contoh.
Contoh: Perhatikan reaksi umum 2A + 2B → 2AB
dan data eksperimen berikut:
Tulislah persamaan laju yang paling mungkin untuk reaksi ini:
Jawaban :
Laju = k[A]°[B2]
atau
Laju = k[B2]
Suatu pereaksi malahan dapat tidak muncul dalam persamaan laju suatu reaksi. Orde suatu reaksi diberikan hanya atas dasar penetapan eksperimental dan sekedar memberi informasi mengenai cara laju itu bergantung pada konsentrasi pereaksi-pereaksi tertentu. Ramalan teoritis mengenai orde-orde (dari) reaksi-reaksi yang kurang dikenal jarang berhasil. Misalnya mengetahui bahwa reaksi antara H2 dan I2 adalah orde kedua mungkin orang akan meramal bahwa reaksi antara H2 dan Br2 juga akan berorde-kedua. Ternyata tidak, malahan reaksi ini mempunyai persamaan laju yang lebih rumit.
Menentukan Orde reaksi
a. Jika tahap reaksi dapat diamati, orde adalah koefisien pada tahap reaksi yang berjalan lambat.
Contoh : reaksi 4HBr + O2 -> 2H2O + 2Br2
Berlangsung dalam tahapan sebagai berikut :
- HBr + O2 -> HBr2O (lambat)
- HBr + HBr2O -> 2HBrO (cepat)
- 2HBr + 2HBr) -> 2H2O + 2Br2 (cepat)
Maka orde reaksi ditentukan oleh reaksi (1). Persamaan laju reaksi, V = [HBr] [O2]. Orde reaksi total (lihat koefisien reaksi) = 1 + 1 = 2.
b. Jika tahap reaksi tidak bisa diamati, orde reaksi ditentukan melalu eksperimen, kosentrasi salah satu zat tetap dan kosentrasi zat lain berubah.
Contoh:
Reaksi : P + Q + R → X + Y
diperoleh data percobaan sebagai berikut :
orde reaksi terhadap P, dicari dengan melihat konsentrasi [Q] dan [R] yang tetap. Dari data (1) dan (3) dari konsentrasi [Q] dan [R] tetap, [P] dinaikkan dua kali.
Jadi reaksi berlangsung 2 kali lebih cepat.
2m = 2 → m = 1
- Orde reaksi terhadap Q, lihat konsentrasi [P] dan [R] yang tetap yakni sebagai berikut.
Data (4) dan (5) o 1,5 kali lebih cepat
Data (1) dan (4) o 2 kali lebih cepat
Data (1) dan (5) o 3 kali lebih cepat
Ingat : orde reaksi ditentukan oleh tahap reaksi yang paling lambat 1,5n = 1,5
n = 1
- Orde reaksi terhadap R, lihat konsentrasi [P] dan [Q] tetap yakni data (1) dan (2). Konsentrasi R dinaikkan 1,5 kali, ternyata reaksi berlangsung sama cepat.1,5x = 1 x = 0 Maka persamaan laju reaksinya sebagai berikut:
V = k[P] [Q]
KESIMPULAN
Laju reaksi. kecepatan laju reaksi di kontrol oleh 5 faktor :
1. sifat reaktan
2. kemampuan reaktan untuk bertemu
3. konsentrasi reaktan
4. temperatur
5. adanya katalis
penentuan lahu reaksi kimia menggunakan persamaan :
Hukum laju untuk reaksi berhubungan dengan laju reaksi dengan konsentrasi molar reaktan.




Tidak ada komentar:
Posting Komentar