KATA MUTIARA PERSAHABATAN
Persahabatan sering menyuguhkan beberapa cobaan, tetapi persahabatan sejati bisa mengatasi cobaan itu bahkan bertumbuh bersama.
Kerinduannya adalah menjadi bagian dari kehidupan sahabatnya, karena tidak ada persahabatan yang diawali dengan sikap egoistis.
Sahabat tidak pernah membungkus pukulan dengan ciuman, tetapi menyatakan apa yang amat menyakitkan dengan tujuan sahabatnya mau berubah.
KIMIA Semester 2
Pereaksi Pembatas (Hitungan Kimia)
Sesuai namanya, pereaksi pembatas adalah zat (pereaksi) yang membatasi jumlah produk yang dihasilkan pada suatu reaksi. Dikatakan membatasi jumlah produk yang dihasilkan karena zat tersebut telah habis terlebih dahulu selagi zat yang lain masih ada, padahal keberadaannya sangat diperlukan untuk reaksi selanjutnya (menghasilkan produk). Jadi, pereaksi pembatas adalah pereaksi yang habis terlebih dahulu (pertama kali).
Pereaksi pembatas dapat ditentukan dengan cara membagi jumlah mol setiap pereaksi masing-masing dengan koefisien reaksinya (= kuosien reaksi, Q). Tentu saja dari reaksi yang sudah setara. Pereaksi dengan kuosien reaksi terkecil merupakan pereaksi pembatas. Dengan demikian kalau tersedia beberapa zat pereaksi dengan jumlahnya masing-masing, kita dapat meramalkan zat pereaksi apa yang nantinya habis terlebih dahulu atau zat apa yang tersisa.
Untuk perhitungan selanjutnya, jumlah (mol) pereaksi pembatas dipakai sebagai pembanding/ standarnya. Baik jumlah produk ataupun zat lain yang bereaksi.
Contoh : Sebanyak 6,5 gram logam Zn (Ar Zn = 65) direaksikan dengan 1000 mL larutan HCl 0,16 M. Tentukan jumlah zat yang tersisa dan volume gas H2 yang dihasilkan (STP). Reaksi yang terjadi :
Zn (s) + 2HCl (aq) –> ZnCl2 (aq) + H2 (g)
Jawab :
Mol Zn = 6,5/65 = 0,1 mol (koefisien reaksi = 1)
Q Zn = 0,1/1 = 0,1
Mol HCl = 1000 x 0,16 = 160 mmol = 0,16 mol (koefisien reaksi = 2)
Q HCl = 0,16/2 = 0,08
Ternyata Q HCl < Q Zn, sehingga HCl merupakan pereaksi pembatas (pereaksi yang habis lebih dulu).
. Zn (s) + 2HCl (aq) —> ZnCl2 (aq) + H2 (g)
Mula2 0,1 0,16 - -
Reaksi -0,08 -0,16 +0,08 +0,08
______________________________________________________ +
Akhir 0,02 mol 0 0,08 mol 0,08 mol
Zat yang tersisa Zn = 0,02 mol
= (0,02 x 65) gram
= 1,30 gram
Gas H2 yang dihasilkan = 0,08 x 22,4 L
= 1,72 L
Baik, demikian sedikit pembahasan tentang pereaksi pembatas. Semoga bermanfaat.
KIMIA Semester 1
Laju Reaksi










 Dengan membandingkan data dalam eksperimen 2 dengan data eksperimen 1, orang akan melihat bahwa bila konsentrasi B2 diduakalikan, maka laju diduakalikan. Jadi reaksi itu berorde pertama dalam B2. Dengan membandingkan data dalam eksperimen 3 dengan data eksperimen 2, orang akan melihat bahwa bila konsentrasi A diduakalikan, laju tidak berubah. Jadi reaksi itu berorde nol dalam A. Maka persamaan laju yang paling mungkin adalah
Dengan membandingkan data dalam eksperimen 2 dengan data eksperimen 1, orang akan melihat bahwa bila konsentrasi B2 diduakalikan, maka laju diduakalikan. Jadi reaksi itu berorde pertama dalam B2. Dengan membandingkan data dalam eksperimen 3 dengan data eksperimen 2, orang akan melihat bahwa bila konsentrasi A diduakalikan, laju tidak berubah. Jadi reaksi itu berorde nol dalam A. Maka persamaan laju yang paling mungkin adalah

Definisi Laju Reaksi
Laju reaksi rerata analog dengan kecepatan rerata mobil. Jika posisi rerata mobil dicatat pada dua waktu yang berbeda, maka :
Dengan cara yang sama, laju reaksi rerata diperoleh dengan membagi perubahan konsentrasi reaktan atau produk dengan interval waktu terjadinya reaksi :
Jika konsentrasi diukur dalam mol L-1 dan waktu dalam detik, maka laju reaksi mempunyai satuan mol L-1s-1. Kita ambil contoh khusus. Dalam reaksi fasa gas
NO2 dan CO dikonsumsi pada saat pembentukan NO dan CO2. Jika sebuah kuar dapat mengukur konsentrasi NO, laju reaksi rerata dapat diperkirakan dari nisbah perubahan konsentrasi NO, ∆[NO] terhadap interval waktu, ∆t:
Jadi laju reaksi adalah besarnya perubahan konsentrasi reaktan atau produk dalam satu satuan waktu. Perubahan laju konsentrasi setiap unsur dibagi dengan koefisiennya dalam persamaan yang seimbang/stoikiometri. Laju perubahan reaktan muncul dengan tanda negatif dan laju perubahan produk dengan tanda positif.
Untuk reaksi yang umum:
aA + bB → cC + dD
Lajunya ialah
Hubungan ini benar selama tidak ada unsur antara atau jika konsentrasinya bergantung pada waktu di sepanjang waktu reaksi.
Menentukan Laju Reaksi :
Perhatikan penguraian nitrogen dioksida, NO2 menjadi nitrogen oksida, NO dan oksigen, O2 : 2NO2 → 2NO + O2
a. Tulislah pernyataan untuk laju rata-rata berkurangnya konsentrasi NO2 dan laju rata-rata bertambahnya konsentrasi NO dan O2.
b. Jika laju rata-rata berkurangnya konsentrasi NO2 ditetapkan dan dijumpai sebesar 4×10-13mol L-1s-1, berapakah laju rata-rata padanannya (dari) bertambahnya konsentrasi NO dan O2
Jawaban :
a. Laju rata-rata berkurangnya konsentrasi NO2 dinyatakan sebagai :
Laju rata-rata bertambahnya konsentrasi NO dan O2 dinyatakan sebagai:
b. Untuk tiap dua molekul NO2 yang bereaksi terbentuk dua molekul NO. Jadi berkurangnya konsentrasi NO2 dan bertambahnya konsentrasi NO berlangsung dengan laju yang sama
Hukum Laju
Dalam membahas reaksi kesetimbangan kimia telah ditekankan bahwa reaksi ke kanan maupun ke kiri dapat terjadi begitu produk terbentuk, produk ini dapat bereaksi kembali menghasilkan reaktan semula.
Laju bersih ialah:
Laju bersih = laju ke kanan – laju ke kiri
Dapat dikatakan, pengukuran konsentrasi memberikan laju bersih, bukannya sekedar laju ke kanan. Bagaimanapun, sesaat sebelum reaksi yang dimulai dari reaktan murni, konsentrasi reaktan jauh lebih tinggi dibandingkan produknya sehingga laju ke kiri dapat diabaikan. Selain itu, banyak reaksi berlangsung sempurna (K>>1) sehingga laju yang terukur hanyalah reaksi ke kanan atau eksperimen dapat diatur agar produknya dapat dialihkan jika terbentuk. Dalam subbab ini, persamaan diberikan pada laju ke kanan saja.
Faktor-faktor yang mempengaruhi kecepatan reaksi
- Kecepatan Reaksi dipengaruhi oleh ukuran partikel/zat.
Semakin luas permukaan maka semakin banyak tempat bersentuhan untuk berlangsungnya reaksi. Luas permukaan zat dapat dicapai dengan cara memperkecil ukuran zat tersebut - Kecepatan Reaksi dipengaruhi oleh suhu.
Semakin tinggi suhu reaksi, kecepatan reaksi juga akan makin meningkat sesuai dengan teori Arhenius. - Kecepatan Reaksi dipengaruhi oleh katalis.
Adanya katalisator dalam reaksi dapat mempercepat jalannya suatu reaksi. Kereakifan dari katalis bergantung dari jenis dan konsentrasi yang digunakan.
Katalis
Katalis adalah suatu zat yang mempercepat suatu laju reaksi, namun ia sendiri, secara kimiawi, tidak berubah pada akhir reaksi. Ketika reaksi selesai, maka akan didapatkan kembali massa katalasis yang sama seperti pada awal ditambahkan.
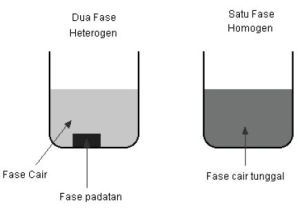
Katalis dapat dibagi berdasarkan dua tipe dasar, yaitu reaksi heterogen dan reaksi homogen. Didalam reaksi heterogen, katalis berada dalam fase yang berbeda dengan reaktan. Sedangkan pada dalam reaksi homogen, katalis berada dalam fase yang sama dengan reaktan.
Jika kita melihat suatu campuran dan dapat melihat suatu batas antara dua komponen, dua komponen itu berada dalam fase yang berbeda. Campuran antara padat dan cair terdiri dari dua fase. Campuran antara beberapa senyawa kimia dalam satu larutan terdiri hanya dari satu fase, karena kita tidak dapat melihat batas antara senyawa-senyawa kimia tersebut.
Fase berbeda denga istilah keadaan fisik (padat, cair dan gas). Fase dapat juga meliputi padat, cair dan gas, akan tetapi lebih sedikit luas. Fase juga dapat diterapkan dalam dua zat cair dimana keduanya tidak saling melarutkan (contoh, minyak dan air).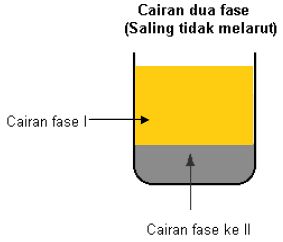

Energi Aktivasi
Tumbukan-tumbukan akan menghasilkan reaksi jika partikel-partikel bertumbukan dengan energi yang cukup untuk memulai suatu reaksi. Energi minimum yang diperlukan disebut dengan reaksi aktivasi energi. Kita dapat menggambarkan keadaan dari energi aktivasi pada distribusi Maxwell-Boltzmann seperti ini:
Orde Reaksi
Orde suatu reaksi ialah jumlah semua eksponen (dari konsentrasi dalam persamaan laju. Orde reaksi juga menyatakan besarnya pengaruh konsentrasi reaktan (pereaksi) terhadap laju reaksi.
Penentuan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan.
Suatu reaksi yang diturunkan secara eksperimen dinyatakan dengan rumus kecepatan reaksi :
v = k (A) (B) 2
persamaan tersebut mengandung pengertian reaksi orde 1 terhadap zat A dan merupakan reaksi orde 2 terhadap zat B. Secara keselurahan reaksi tersebut adalah reaksi orde 3.
Contoh soal:
Dari reaksi 2NO(g) + Br2(g) → 2NOBr(g)
dibuat percobaan dan diperoleh data sebagai berikut:
| No. | (NO) mol/l | (Br2) mol/l | Kecepatan Reaksi mol / 1 / detik |
| 1. | 0.1 | 0.1 | 12 |
| 2. | 0.1 | 0.2 | 24 |
| 3. | 0.1 | 0.3 | 36 |
| 4. | 0.2 | 0.1 | 48 |
| 5. | 0.3 | 0.1 | 108 |
Pertanyaan:
a. Tentukan orde reaksinya !
b. Tentukan harga k (tetapan laju reaksi) !
b. Tentukan harga k (tetapan laju reaksi) !
Jawab:
a.Pertama-tama kita misalkan rumus kecepatan reaksinya adalah V = k(NO)x(Br2)y : jadi kita harus mencari nilai x den y.
Untuk menentukan nilai x maka kita ambil data dimana konsentrasi terhadap Br2 tidak berubah, yaitu data (1) dan (4).
Dari data ini terlihat konsentrasi NO naik 2 kali sedangkan kecepatan reaksinya naik 4 kali maka :
Untuk menentukan nilai x maka kita ambil data dimana konsentrasi terhadap Br2 tidak berubah, yaitu data (1) dan (4).
Dari data ini terlihat konsentrasi NO naik 2 kali sedangkan kecepatan reaksinya naik 4 kali maka :
2x = 4 → x = 2 (reaksi orde 2 terhadap NO)
Untuk menentukan nilai y maka kita ambil data dimana konsentrasi terhadap NO tidak berubah yaitu data (1) dan (2). Dari data ini terlihat konsentrasi Br2 naik 2 kali, sedangkan kecepatan reaksinya naik 2 kali, maka :
2y = 2 → y = 1 (reaksi orde 1 terhadap Br2)
Jadi rumus kecepatan reaksinya : V = k(NO)2(Br2) (reaksi orde 3)
b.Untuk menentukan nilai k cukup kita ambil salah satu data percobaan saja misalnya data (1), maka:
V = k(NO)2(Br2)
12 = k(0.1)2(0.1)
12 = k(0.1)2(0.1)
k = 12 x 103 mol-212det-1
Jika laju suatu reaksi berbanding lurus dengan pangkat satu konsentrasi dari hanya satu pereaksi.
Laju = k [A]
Maka reaksi itu dikatakan sebagai reaksi orde pertama. Penguraian N2O5 merupakan suatu contoh reaksi orde pertama. Jika laju reaksi itu berbanding lurus dengan pangkat dua suatu pereaksi,
Laju = k[A]2
Atau berbanding lurus dengan pangkat satu konsentrasi dari dua pereaksi,
Laju = k [A][B]
Maka reaksi itu disebut reaksi orde kedua. Dapat juga disebut orde terhadap masing-masing pereaksi. Misalnya dalam persamaan terakhir itu adalah orde pertama dalam A dan orde dalam B, atau orde kedua secara keseluruhan. Suatu reaksi dapat berorde ketiga atau mungkin lebih tinggi lagi, tetapi hal-hal semacam itu sangat jarang. Dalam reaksi yang rumit, laju itu mungkin berorde pecahan, misalnya orde pertama dalam A dan orde 0,5 dalam B atau berorde 1,5 secara keseluruhan.
Suatu reaksi dapat tak tergantung pada konsentrasi suatu pereaksi. Perhatikan reaksi umum, yang ternyata berorde pertama dalam A. Jika kenaikan konsentrasi B tidak menaikkan laju reaksi, maka reaksi itu disebut orde nol terhadap B. Ini bisa diungkapkan sebagai :
Laju = k[A][B]0 = k[A]
Orde suatu reaksi tak dapat diperoleh dari koefisien pereaksi dalam persamaan berimbangnya. Dalam penguraian N2O5 dan NO2, koefisien untuk pereaksi dalam masing-masing persamaan berimbang adalah 2 tetapi reaksi pertama bersifat orde pertama dalam N2O5 dan yang kedua berorde kedua dalam NO2. Seperti dilukiskan oleh contoh.
Contoh: Perhatikan reaksi umum 2A + 2B → 2AB
dan data eksperimen berikut:
Tulislah persamaan laju yang paling mungkin untuk reaksi ini:
Jawaban :
Laju = k[A]°[B2]
atau
Laju = k[B2]
Suatu pereaksi malahan dapat tidak muncul dalam persamaan laju suatu reaksi. Orde suatu reaksi diberikan hanya atas dasar penetapan eksperimental dan sekedar memberi informasi mengenai cara laju itu bergantung pada konsentrasi pereaksi-pereaksi tertentu. Ramalan teoritis mengenai orde-orde (dari) reaksi-reaksi yang kurang dikenal jarang berhasil. Misalnya mengetahui bahwa reaksi antara H2 dan I2 adalah orde kedua mungkin orang akan meramal bahwa reaksi antara H2 dan Br2 juga akan berorde-kedua. Ternyata tidak, malahan reaksi ini mempunyai persamaan laju yang lebih rumit.
Menentukan Orde reaksi
a. Jika tahap reaksi dapat diamati, orde adalah koefisien pada tahap reaksi yang berjalan lambat.
Contoh : reaksi 4HBr + O2 -> 2H2O + 2Br2
Berlangsung dalam tahapan sebagai berikut :
- HBr + O2 -> HBr2O (lambat)
- HBr + HBr2O -> 2HBrO (cepat)
- 2HBr + 2HBr) -> 2H2O + 2Br2 (cepat)
Maka orde reaksi ditentukan oleh reaksi (1). Persamaan laju reaksi, V = [HBr] [O2]. Orde reaksi total (lihat koefisien reaksi) = 1 + 1 = 2.
b. Jika tahap reaksi tidak bisa diamati, orde reaksi ditentukan melalu eksperimen, kosentrasi salah satu zat tetap dan kosentrasi zat lain berubah.
Contoh:
Reaksi : P + Q + R → X + Y
diperoleh data percobaan sebagai berikut :
orde reaksi terhadap P, dicari dengan melihat konsentrasi [Q] dan [R] yang tetap. Dari data (1) dan (3) dari konsentrasi [Q] dan [R] tetap, [P] dinaikkan dua kali.
Jadi reaksi berlangsung 2 kali lebih cepat.
2m = 2 → m = 1
- Orde reaksi terhadap Q, lihat konsentrasi [P] dan [R] yang tetap yakni sebagai berikut.
Data (4) dan (5) o 1,5 kali lebih cepat
Data (1) dan (4) o 2 kali lebih cepat
Data (1) dan (5) o 3 kali lebih cepat
Ingat : orde reaksi ditentukan oleh tahap reaksi yang paling lambat 1,5n = 1,5
n = 1
- Orde reaksi terhadap R, lihat konsentrasi [P] dan [Q] tetap yakni data (1) dan (2). Konsentrasi R dinaikkan 1,5 kali, ternyata reaksi berlangsung sama cepat.1,5x = 1 x = 0 Maka persamaan laju reaksinya sebagai berikut:
V = k[P] [Q]
KESIMPULAN
Laju reaksi. kecepatan laju reaksi di kontrol oleh 5 faktor :
1. sifat reaktan
2. kemampuan reaktan untuk bertemu
3. konsentrasi reaktan
4. temperatur
5. adanya katalis
penentuan lahu reaksi kimia menggunakan persamaan :
Hukum laju untuk reaksi berhubungan dengan laju reaksi dengan konsentrasi molar reaktan.
FISIKA Semester 2
Materi Fisika Semester 2 Kelas XI
USAHA DAN ENERGI
Energy Kinetik Rotasi
Hukum kekekalan momentum diterapkan pada proses tumbukan semua jenis, dimana prinsip impuls mendasari proses tumbukan dua benda, yaitu I1 = -I2.Jika dua benda A dan B dengan massa masing-masing MA dan MB serta kecepatannya masing-masing VA dan VB saling bertumbukan, maka :
MA VA + MB VB = MA VA + MB VB
VA dan VB = kecepatan benda A dan B pada saat tumbukan
VA dan VB = kecepatan benda A den B setelah tumbukan.
Dalam penyelesaian soal, searah vektor ke kanan dianggap positif, sedangkan ke kiri dianggap negatif.
Dua benda yang bertumbukan akan memenuhi tiga keadaan/sifat ditinjau dari keelastisannya,
a. ELASTIS SEMPURNA : e = 1
e = (- VA' - VB')/(VA - VB)
e = koefisien restitusi.
Disini berlaku hukum kokokalan energi den kokekalan momentum.
b. ELASTIS SEBAGIAN: 0 <>Disini hanya berlaku hukum kekekalan momentum.
Khusus untuk benda yang jatuh ke tanah den memantul ke atas lagi maka koefisien restitusinya adalah:
e = h'/h
h = tinggi benda mula-mula
h' = tinggi pantulan benda
C. TIDAK ELASTIS: e = 0 Setelah tumbukan, benda melakukan gerak yang sama dengan satu kecepatan v',
MA VA + MB VB = (MA + MB) v'
Disini hanya berlaku hukum kekekalan momentum
Pada awal perkembangan roket, roket digerakan dari hasil pembakaran bahan bakar minyak gas dan oksigen cair, untuk menghasilkan gas panas yang meledak ke bawah dan mendorong roket ke atas. Untuk roket V-2 yang dikembangkan Hitler, menggunakan turbin uap untuk memompa alkohol dan oksigen cair ke dalam ruang bakar yang menghasilkan ledakan beruntun yang mendorong roket ke atas. Prinsip kerja roket merupakan penerapan dari Hukum Newton III tentang gerak, dimana energi panas diubah menjadi energi gerak.
Prinsip kerja dari roket berbahan bakar cair dan padat sama, di mana hasil pembakaran menghasilkan gaya dorong ke atas. Kelebihan dari roket berbahan bakar padat mampu menyimpan bahan bakar dengan dengan jumlah besar untuk ruang penyimpanan yang sama, karena telah dipadatkan, sedangkan bahan bakar cair tidak bisa dimampatkan.
DINAMIKA ROTASI

MOMEN GAYA ( t ) adalah gaya kali jarak/lengan.
Arah gaya dan arah jarak harus tegak lurus.
Lambang I dan kadang-kadang juga J biasanya digunakan untuk merujuk kepada momen inersia.
Berdasarkan analisis dimensi saja, momen inersia sebuah objek bukan titik haruslah mengambil bentuk:
 karena aт = r α, maka
karena aт = r α, maka
Tekanan yang dilakukan pada zat cair akan diteruskan ke semua arah sama.
P1 = P2 ® F1/A1 = F2/A2
HUKUM ARCHIMEDES
Benda di dalam zat cair akan mengalami pengurangan berat sebesar berat zat cair yang dipindahkan.
Tiga keadaan benda di dalam zat cair:
W = berat benda
Fa = gaya ke atas = rz . V' . g
rb = massa jenis benda
rz = massa jenis fluida
V = volume benda
V' = volume benda yang berada dalam fluida
Akibat adanya gaya ke atas ( Fa ), berat benda di dalam zat cair (Wz) akan berkurang menjadi:
Wz = W - Fa
Wz = berat benda di dalam zat cair
TEGANGAN PERMUKAAN
Tegangan permukaan ( g) adalah besar gaya ( F ) yang dialami pada permukaan zat cair persatuan panjang(l)
g = F / 2l
KAPILARITAS
Kapilaritas ialah gejala naik atau turunnya zat cair ( y ) dalam tabung kapiler yang dimasukkan sebagian ke dalam zat cair karena pengarah adhesi dan kohesi.
y = 2 g cos q / r g r
y = kenaikan/penurunan zat cair pada pipa (m) g = tegangan permukaan (N/m)
q = sudut kontak (derajat)
p = massa jenis zat cair (kg / m3) g = percepatan gravitas (m / det2)
r = jari-jari tabung kapiler (m)
FLUIDA DINAMIS
Sifat Fluida Ideal:
- tidak dapat ditekan (volume tetap karena tekanan)
- dapat berpindah tanpa mengalami gesekan
- mempunyai aliran stasioner (garis alirnya tetap bagi setiap partikel)
- kecepatan partikel-partikelnya sama pada penampang yang sama
HUKUM BERNOULLI
Hukum ini diterapkan pada zat cair yang mengalir dengan kecepatan berbeda dalam suatu pipa.
CEPAT ALIRAN (DEBIT AIR)
Cepat aliran (Q) adalah volume fluida yang dipindahkan tiap satuan waktu.
Q = A . v
A1 . v1 = A2 . v2
v = kecepatan fluida (m/det)
A = luas penampang yang dilalui fluida
Untuk zat cair yang mengalir melalui sebuah lubang pada tangki, maka besar kecepatannya selalu dapat diturunkan dari Hukum Bernoulli, yaitu:
Contoh:
1. Sebuah kolam air berdinding bujursangkar dengan panjang 15 m, tingginya 7,5m.Tentukanlah tekanan air 4,5 m di bawah permukaan air!
Jawab:
P = r . g . h = 103 . 10 . 4,5
P = 4,5.104 N/m2
2. Air mengalir sepanjang pipa horisontal, penampang tidak sama besar. Pada tempat dengan kecepatan air 35 cm/det tekanannya adalah 1 cmHg. Tentukanlah tekanan pada bagian pipa dimana kecepatan aliran airnya 65 cm/det.(g = 980 cm/det2) !
Jawab:
P1 = 1 cmHg = 1.13,6.980 dyne/cm2
P1 = 13328 dyne/cm2
v1 = 35 cm/det; v2 = 65 cm/det
 Prinsip Bernoulli:
Prinsip Bernoulli:
P1 + pgy1 + 1/2rv12 = P2 + rgy2 + 1/2rv22
Karena y1 = y2 (pipa horisontal), maka:
P1 - P2 = 1/2 r (V22 - V12)
P1 - P2 = 1/2 1 (652 352)
P1 - P2 = 1/2 3000
P1 - P2 = 1500 dyne/cm2
Jadi:
P2 = P1 - 1500
P2 = 13328 - 1500
P2 = 11828 dyne/cm
P2 = 0,87 cmHg
HUKUM ARCHIMIDES
Apabila benda yang dimasukkan ke dalam fluida, terapung, di mana bagian benda yang tercelup hanya sebagian maka volume fluida yang dipindahkan = volume bagian benda yang tercelup dalam fluida tersebut. Tidak peduli apapun benda dan bagaimana bentuk benda tersebut, semuanya akan mengalami hal yang sama. Ini adalah buah karya eyang butut Archimedes (287-212 SM) yang saat ini diwariskan kepada kita dan lebih dikenal dengan julukan “Prinsip Archimedes”. Prinsip Archimedes menyatakan bahwa :
Ketika sebuah benda tercelup seluruhnya atau sebagian di dalam zat cair, zat cair akan memberikan gaya ke atas (gaya apung) pada benda, di mana besarnya gaya ke atas (gaya apung) sama dengan berat zat cair yang dipindahkan.
PERSAMAAN TEGANGAN PERMUKAAN
Jika kawat U dimasukan ke dalam larutan sabun, maka setelah dikeluarkan akan terbentuk lapisan air sabun pada permukaan kawat tersebut. Mirip seperti ketika dirimu bermain gelembung sabun. Karena kawat lurus bisa digerakkan dan massanya tidak terlalu besar, maka lapisan air sabun akan memberikan gaya tegangan permukaan pada kawat lurus sehingga kawat lurus bergerak ke atas (perhatikan arah panah). Untuk mempertahankan kawat lurus tidak bergerak (kawat berada dalam kesetimbangan), maka diperlukan gaya total yang arahnya ke bawah, di mana besarnya gaya total adalah F = w + T. Dalam kesetimbangan, F = gaya tegangan permukaan yang dikerjakan oleh lapisan air sabun pada kawat lurus.
Misalkan panjang kawat lurus adalah l. Karena lapisan air sabun yang menyentuh kawat lurus memiliki dua permukaan, maka gaya tegangan permukaan yang ditimbulkan oleh lapisan air sabun bekerja. Tegangan permukaan pada lapisan sabun merupakan perbandingan antara Gaya Tegangan Permukaan (F) dengan panjang permukaan di mana gaya bekerja (d). Untuk kasus ini, panjang permukaan adalah 2l.
Karena tegangan permukaan merupakan perbandingan antara Gaya tegangan permukaan dengan Satuan panjang, maka satuan tegangan permukaan adalah Newton per meter (N/m) atau dyne per centimeter (dyn/cm).
1 dyn/cm = 10-3 N/m = 1 mN/m
TERMODINAMIKA
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal.
Hukum kekekalan energi adalah salah satu dari hukum-hukum kekekalan yang meliputi energi kinetik dan energi potensial. Hukum ini adalah hukum pertama dalam termodinamika.
Asas Black adalah suatu prinsip dalam termodinamika yang dikemukakan oleh Joseph Black. Asas ini menjabarkan:
* Jika dua buah benda yang berbeda yang suhunya dicampurkan, benda yang panas memberi kalor pada benda yang dingin sehingga suhu akhirnya sama
* Jumlah kalor yang diserap benda dingin sama dengan jumlah kalor yang dilepas benda panas
* Benda yang didinginkan melepas kalor yang sama besar dengan kalor yang diserap bila dipanaskan
Rumus Asas Black =
(M1 X C1) (T1-Ta) = (M2 X C2) (Ta-T2)
Catatan :
M1 = Massa benda yang mempunyai tingkat temperatur lebih tinggi
C1 = Kalor jenis benda yang mempunyai tingkat temperatur lebih tinggi
Ta = Temperatur benda yang mempunyai tingkat temperatur lebih tinggi
T1 = Temperatur akhir pencampuran kedua benda
M2 = Massa benda yang mempunyai tingkat temperatur lebih rendah
C2 = Kalor jenis benda yang mempunyai tingkat temperatur lebih rendah
T2 = Temperatur benda yang mempunyai tingkat temperatur lebih rendah
HUKUM I TERMODINAMIKA
Hukum Kekekalan Energi (Hukum I Termodinamika) berbunyi: "Energi dapat berubah dari satu bentuk ke bentuk yang lain tapi tidak bisa diciptakan ataupun dimusnahkan (konversi energi)".
Keterangan :
delta U = Perubahan energi dalam
Q = Kalor
W = Kerja
Hukum pertama termodinamika merupakan pernyataan Hukum Kekekalan Energi dan ketepatannya telah dibuktikan melalui banyak percobaan (seperti percobaan om Jimi Joule). Perlu diketahui bahwa hukum ini dirumuskan pada abad kesembilan belas, setelah kalor dipahami sebagai energi yang berpindah akibat adanya perbedaan suhu.
HUKUM II TERMODINAMIKA
Kalor berpindah dengan sendirinya dari benda bersuhu tinggi ke benda bersuhu rendah; kalor tidak akan berpindah dengan sendirinya dari benda bersuhu rendah ke benda bersuhu tinggi (Hukum kedua termodinamika
Energy Kinetik Rotasi
Sebuah benda yang bergerak rotasi memiliki energy kinetic karena partikel-partikelnya bergerak terus walaupun secara keseluruhan benda tersebut tetap di tempatnya (tidak bergerak translasi).
Energy kinetic sebuah partikel dalam benda adalah : Ek = ½ m v2 =½ m ω2 r2
Maka energy kinetic seluruh partikel benda, atau energy kinetic rotasi benda adalah : Ek = Σ ½ m v2 = ½ (Σm r2) ω2 atau Ek =½ I ω2
2.1.1. Kombinasi Gerak Translasi dan Gerak Rotasi
Bila sebuah benda tegar bergerak melalui sebuah ruang dan pada saat yang bersamaan melakukan gerak rotasi (menggelinding), maka energy kinetic benda itu adalah total antara energy kinetic translasinya dengan energy kinetic rotasinya.
Ek = Ek translasi + Ek rotasi
Jadi, Ek = ½ m v2 + ½ I ω2
2.2. Usaha dan Gaya pada Gerak Rotasi
Usaha yang dilakukan oleh gay F pada benda adalah :
W = F s = F r θ
→ W = τ θ
Sedangkan daya :
P= W/t = Frθ/t = Fr θ/t
Jika kecepatan anguler konstan, maka
→ P = τ ω
HUKUM KEKEKALAN MOMENTUM
Hukum kekekalan momentum diterapkan pada proses tumbukan semua jenis, dimana prinsip impuls mendasari proses tumbukan dua benda, yaitu I1 = -I2.Jika dua benda A dan B dengan massa masing-masing MA dan MB serta kecepatannya masing-masing VA dan VB saling bertumbukan, maka :
MA VA + MB VB = MA VA + MB VB
VA dan VB = kecepatan benda A dan B pada saat tumbukan
VA dan VB = kecepatan benda A den B setelah tumbukan.
Dalam penyelesaian soal, searah vektor ke kanan dianggap positif, sedangkan ke kiri dianggap negatif.
Dua benda yang bertumbukan akan memenuhi tiga keadaan/sifat ditinjau dari keelastisannya,
a. ELASTIS SEMPURNA : e = 1
e = (- VA' - VB')/(VA - VB)
e = koefisien restitusi.
Disini berlaku hukum kokokalan energi den kokekalan momentum.
b. ELASTIS SEBAGIAN: 0 <>Disini hanya berlaku hukum kekekalan momentum.
Khusus untuk benda yang jatuh ke tanah den memantul ke atas lagi maka koefisien restitusinya adalah:
e = h'/h
h = tinggi benda mula-mula
h' = tinggi pantulan benda
C. TIDAK ELASTIS: e = 0 Setelah tumbukan, benda melakukan gerak yang sama dengan satu kecepatan v',
MA VA + MB VB = (MA + MB) v'
Disini hanya berlaku hukum kekekalan momentum
PRINSIP KERJA ROKET
Pada awal perkembangan roket, roket digerakan dari hasil pembakaran bahan bakar minyak gas dan oksigen cair, untuk menghasilkan gas panas yang meledak ke bawah dan mendorong roket ke atas. Untuk roket V-2 yang dikembangkan Hitler, menggunakan turbin uap untuk memompa alkohol dan oksigen cair ke dalam ruang bakar yang menghasilkan ledakan beruntun yang mendorong roket ke atas. Prinsip kerja roket merupakan penerapan dari Hukum Newton III tentang gerak, dimana energi panas diubah menjadi energi gerak.
Prinsip kerja dari roket berbahan bakar cair dan padat sama, di mana hasil pembakaran menghasilkan gaya dorong ke atas. Kelebihan dari roket berbahan bakar padat mampu menyimpan bahan bakar dengan dengan jumlah besar untuk ruang penyimpanan yang sama, karena telah dipadatkan, sedangkan bahan bakar cair tidak bisa dimampatkan.
DINAMIKA ROTASI
MOMEN GAYA
Penyebab terjadinya gerak translasi adalah gaya. Sedangkan pada gerak rotasi, penyebab berputarnya benda dinamakan momen gaya ( = torsi).Contoh dalam kehidupan sehari-hari: - Pegangan pintu yang diberikan gaya oleh tangan kita sehingga engsel di dalamnya dapat berputar - Kincir yang berputar karena tertiup angin - Dll. 
MOMEN GAYA ( t ) adalah gaya kali jarak/lengan.
Arah gaya dan arah jarak harus tegak lurus.
Untuk benda panjang:
| Untuk benda berjari jari:
|
F = gaya penyebab benda berotasi
R = jari-jari
I = lengan gaya terhadap sumbu
I = m . R2 = momen inersia benda
a = percepatan sudut / angular
R = jari-jari
I = lengan gaya terhadap sumbu
I = m . R2 = momen inersia benda
a = percepatan sudut / angular
MOMEN INERSIA
Momen inersia (satuan SI kg m2) adalah ukuran ketahanan objek terhadap perubahan laju Besaran ini adalah analog rotasi daripada rotasinya massa. Dengan kata lain, besaran ini adalah kelembaman sebuah benda tegar yang berputar terhadap rotasinya. Momen inersia berperan dalam dinamika rotasi seperti massa dalam dinamika dasar, dan menentukan hubungan antaramomentum sudut dan kecepetan sudut, momen gaya dan percepatan sudut, dan beberapa besaran lain. Meskipun pembahasan skalar terhadap momen inersia, pembahasan menggunakan pendekatan tensor memungkinkan analisis sistem yang lebih rumit seperti gerakan giroskopik.Lambang I dan kadang-kadang juga J biasanya digunakan untuk merujuk kepada momen inersia.
DEFINISI SKALAR
Definisi sederhana momen inersia (terhadap sumbu rotasi tertentu) dari sembarang objek, baik massa titik atau struktur tiga dimensi, diberikan oleh rumus:Analisis
Momen inersia (skalar) sebuah massa titik yang berputar pada sumbu yang diketahui didefinisikan oleh- V adalah volume yang ditempati objek
- ρ adalah fungsi kerapatan spasial objek
- r = (r,θ,φ), (x,y,z), atau (r,θ,z) adalah vektor (tegaklurus terhadap sumbu rotasi) antara sumbu rotasi dan titik di benda tersebut.
- M adalah massa
- R adalah jari-jari objek dari pusat massa (dalam beberapa kasus, panjang objek yang digunakan)
- k adalah konstanta tidak berdimensi yang dinamakan "konstanta inersia", yang berbeda-beda tergantung pada objek terkait.
- k = 1, cincin tipis atau silinder tipis di sekeliling pusat
- k = 2/5, bola pejal di sekitar pusat
- k = 1/2, silinder atau piringan pejal di sekitar pusat.
Momen Gaya (Torsi = τ)
Momen gaya adalah ukuran besar kecilnya efek putar sebuah gaya. Untuk sumbu tetap dan gaya-gaya yang tidak mempunyai komponen yang sejajar dengan sumbu tersebut.
Momen gaya : τ = r F sin α
dengan α = sudut antara r dan F
1.4. Momen Gaya dan Percepatan Anguler
Sebuah gaya F yang bekerja pada sebuah partikel m secara tangensial (menyinggung lintasan) akan memberikan percepatan tangensial aт yang memenuhi :
F = m aт
 karena aт = r α, maka
karena aт = r α, maka
F = m r α
F r = m r2 α → τ = I α
Persamaan di atas juga berlaku untuk sembarang benda tegar, asalkan momen gaya dan momen inersianya dihitung terhadap sumbu yang sama. Persamaan di atas merupakan hokum dasar untuk gerak rotasi.
Titik Pusat Massa dan Titik (Pusat) Berat
 Koordinat pusat massa Sistem Partikel (benda tak kontinu) :
Koordinat pusat massa Sistem Partikel (benda tak kontinu) :
 Absis pusat massa benda homogeny 1 dimensi :
Absis pusat massa benda homogeny 1 dimensi :
 Absis pusat massa benda homogeny 2 dimensi :
Absis pusat massa benda homogeny 2 dimensi :
 Absis pusat massa benda homogeny 3 dimensi :
Absis pusat massa benda homogeny 3 dimensi : V = volume
V = volume
 Diam, disebut seimbang statis
Diam, disebut seimbang statis Bergerak dengan kecepatan konstan, disebut seimbang dinamis
Bergerak dengan kecepatan konstan, disebut seimbang dinamis
 Momen gaya yang menyebabkan rotasi searah jarum jam diberi tanda positif.
Momen gaya yang menyebabkan rotasi searah jarum jam diberi tanda positif. Momen gaya yang menyebabkan rotasi berlawanan arah jarum jam diberi tanda negative.
Momen gaya yang menyebabkan rotasi berlawanan arah jarum jam diberi tanda negative.
 Kesimbangan Stabil
Kesimbangan Stabil
 Keseimbangan Labil
Keseimbangan Labil
 Keseimbangan Netral (Indiferen)
Keseimbangan Netral (Indiferen)
Tekanan hidrostatis ( Ph) adalah tekanan yang dilakukan zat cair pada bidang dasar tempatnya.
PARADOKS HIDROSTATIS
Gaya yang bekerja pada dasar sebuah bejana tidak tergantung pada bentuk bejana dan jumlah zat cair dalam bejana, tetapi tergantung pada luas dasar bejana ( A ), tinggi ( h ) dan massa jenis zat cair ( r )
dalam bejana.
HUKUM PASCALTitik Pusat Massa dan Titik (Pusat) Berat
6.1. Titik Pusat Massa
Titik pusat massa adalah sebuah titik dimana seluruh benda dapat dipusatkan padanya. Jika resultan gaya bekerja melelui titik pusat massa, maka benda akan bergerak translasi murni.
Untuk system benda dua dimensi, letak titik pusat massa dinyatakan dengan koordinat (xpm , ypm), dengan :
Xpm =  dan ypm =
dan ypm = 
6.2. Titik Pusat Berat
Titik pusat berat adalah titik tangkap gaya berat yang bekerja pada sebuah benda.
Untuk system benda dua dimensi, letak titik pusat berat dinyatakan dengan koordinat (xpb , ypb), dengan :
Xpb =  dan ypb =
dan ypb = 
Letak titk pusat massa benda pada umumnya tidak sama dengan letak titik pusat berat benda.
Untuk benda yang letaknya dekat dengan permukaan bumi, dimana g dianggap konstan, letak pusat massa dan titik berat sebuah benda dapat dianggap berhimpit.
Xpm =  =
= 
dan
ypm =  =
= 
Xpm =  l = panjang
l = panjang
Xpm =  A = luas
A = luas
Keseimbangan
1. Keseimbangan Pertikel
Sebuah partikel atau benda titik dikatakan seimbang jika resultan gaya-gaya yang bekerja padanya sama dengan nol.
Σ F = 0
Partikel atau benda titik yang seimbang, mungkin berada dalam salah satu dari dua keadaan berikut :
2. Momen Gaya (Torsi)
Momen gaya atau torsi pada sebuah benda menyebabkan benda tersebut berotasi. Ia didefinisikan sebagai berikut (momen dari gaya F terhadap poros, sumbu putar, O)
τ = F Lт atau τ = Fт L
catatan.
3. Momen Kopel
Kopel adalah dua buah gaya yang sama besar, berlawanan arah, tetapi tidak segaris kerja. Kopel yang bekerja pada sebuah benda menghasilkan rotasi murni.
Momen kopel dapat dinyatakan sebagai berikut :
M = F d
4. Resultan Gaya Sejajar
Gaya-gaya sejajar mempunyai resultan gaya letak titik tangkapnya sedemikian rupa sehingga resultan momen gaya terhadap titik tersebut adalah nol.
Resultan gaya : FR = F1 + F2
5. Keseimbangan Benda Tegar
Benda yang tidak berubah bentuk ketika dipengaruhi oleh gaya dinamakan benda tegar. Benda tegar dapat bergerak translasi murni, rotasi murni, atau kombinasi keduanya. Bneda tegar dikatakan seimbang bila memenuhi syarat keseimbangan translasi dan keseimbangan rotasi, yaitu :
ΣF = 0 dan Στ = 0Jenis Keseimbangan
Keadaan keseimbangan suatu benda dapat digolongkan ke dalam salah satu dari 3 jenis keseimbangan berikut :
Benda di katakana dalam keseimbangan stabil bila benda diberi sedikit usikan, dan kemudian usikan dihilangkan, benda kembali ke posisi keseimbangan semula.
 |
Benda dikatakan dalam keseimbangan labil bila benda diberi sedikit usikan, dan kemudian usikan dihilangkan, benda menjauhi posisi keseimbangan semula (jatuh).
 |
Benda dikatakan dalam keseimbangan netral (indiferen) bila benda diberi sedikit usikan, dan kemudian usikan dihilangkan, benda membentuk posisi keseimbangan baru di dekat posisi keseimbangan semula.
FLUIDA
TEKANAN HIDROSTATIS
FLUIDA STATISFluida ( zat alir ) adalah zat yang dapat mengalir, misalnya zat cair dan gas. Fluida dapat digolongkan dalam dua macam, yaitu fluida statis dan dinamis.
Tekanan hidrostatis ( Ph) adalah tekanan yang dilakukan zat cair pada bidang dasar tempatnya.
PARADOKS HIDROSTATIS
Gaya yang bekerja pada dasar sebuah bejana tidak tergantung pada bentuk bejana dan jumlah zat cair dalam bejana, tetapi tergantung pada luas dasar bejana ( A ), tinggi ( h ) dan massa jenis zat cair ( r )
dalam bejana.
| Ph = r g h Pt = Po + Ph F = P h A = r g V | r = massa jenis zat cair h = tinggi zat cair dari permukaan g = percepatan gravitasi Pt = tekanan total Po = tekanan udara luar |  |
Tekanan yang dilakukan pada zat cair akan diteruskan ke semua arah sama.
P1 = P2 ® F1/A1 = F2/A2
HUKUM ARCHIMEDES
Benda di dalam zat cair akan mengalami pengurangan berat sebesar berat zat cair yang dipindahkan.
Tiga keadaan benda di dalam zat cair:
| a. tenggelam: W>Fa Þ rb > rz b. melayang: W = Fa Þ rb = rz c. terapung: W=Fa Þ rb.V=rz.V' ; rb<rz |  |
Fa = gaya ke atas = rz . V' . g
rb = massa jenis benda
rz = massa jenis fluida
V = volume benda
V' = volume benda yang berada dalam fluida
Akibat adanya gaya ke atas ( Fa ), berat benda di dalam zat cair (Wz) akan berkurang menjadi:
Wz = W - Fa
Wz = berat benda di dalam zat cair
TEGANGAN PERMUKAAN
Tegangan permukaan ( g) adalah besar gaya ( F ) yang dialami pada permukaan zat cair persatuan panjang(l)
g = F / 2l
KAPILARITAS
Kapilaritas ialah gejala naik atau turunnya zat cair ( y ) dalam tabung kapiler yang dimasukkan sebagian ke dalam zat cair karena pengarah adhesi dan kohesi.
 |  |
y = kenaikan/penurunan zat cair pada pipa (m) g = tegangan permukaan (N/m)
q = sudut kontak (derajat)
p = massa jenis zat cair (kg / m3) g = percepatan gravitas (m / det2)
r = jari-jari tabung kapiler (m)
FLUIDA DINAMIS
Sifat Fluida Ideal:
- tidak dapat ditekan (volume tetap karena tekanan)
- dapat berpindah tanpa mengalami gesekan
- mempunyai aliran stasioner (garis alirnya tetap bagi setiap partikel)
- kecepatan partikel-partikelnya sama pada penampang yang sama
HUKUM BERNOULLI
Hukum ini diterapkan pada zat cair yang mengalir dengan kecepatan berbeda dalam suatu pipa.
| P + r g Y + 1/2 r v2 = c P = tekanan 1/2 r v2 = Energi kinetik r g y = Energi potensial | ]® tiap satuan waktu |  |
CEPAT ALIRAN (DEBIT AIR)
Cepat aliran (Q) adalah volume fluida yang dipindahkan tiap satuan waktu.
Q = A . v
A1 . v1 = A2 . v2
v = kecepatan fluida (m/det)
A = luas penampang yang dilalui fluida
Untuk zat cair yang mengalir melalui sebuah lubang pada tangki, maka besar kecepatannya selalu dapat diturunkan dari Hukum Bernoulli, yaitu:
| v = Ö(2gh) |
h = kedalaman lubang dari permukaan zat cair
|
1. Sebuah kolam air berdinding bujursangkar dengan panjang 15 m, tingginya 7,5m.Tentukanlah tekanan air 4,5 m di bawah permukaan air!
Jawab:
P = r . g . h = 103 . 10 . 4,5
P = 4,5.104 N/m2
2. Air mengalir sepanjang pipa horisontal, penampang tidak sama besar. Pada tempat dengan kecepatan air 35 cm/det tekanannya adalah 1 cmHg. Tentukanlah tekanan pada bagian pipa dimana kecepatan aliran airnya 65 cm/det.(g = 980 cm/det2) !
Jawab:
P1 = 1 cmHg = 1.13,6.980 dyne/cm2
P1 = 13328 dyne/cm2
v1 = 35 cm/det; v2 = 65 cm/det

P1 + pgy1 + 1/2rv12 = P2 + rgy2 + 1/2rv22
Karena y1 = y2 (pipa horisontal), maka:
P1 - P2 = 1/2 r (V22 - V12)
P1 - P2 = 1/2 1 (652 352)
P1 - P2 = 1/2 3000
P1 - P2 = 1500 dyne/cm2
Jadi:
P2 = P1 - 1500
P2 = 13328 - 1500
P2 = 11828 dyne/cm
P2 = 0,87 cmHg
HUKUM ARCHIMIDES
Apabila benda yang dimasukkan ke dalam fluida, terapung, di mana bagian benda yang tercelup hanya sebagian maka volume fluida yang dipindahkan = volume bagian benda yang tercelup dalam fluida tersebut. Tidak peduli apapun benda dan bagaimana bentuk benda tersebut, semuanya akan mengalami hal yang sama. Ini adalah buah karya eyang butut Archimedes (287-212 SM) yang saat ini diwariskan kepada kita dan lebih dikenal dengan julukan “Prinsip Archimedes”. Prinsip Archimedes menyatakan bahwa :
Ketika sebuah benda tercelup seluruhnya atau sebagian di dalam zat cair, zat cair akan memberikan gaya ke atas (gaya apung) pada benda, di mana besarnya gaya ke atas (gaya apung) sama dengan berat zat cair yang dipindahkan.
PERSAMAAN TEGANGAN PERMUKAAN
Jika kawat U dimasukan ke dalam larutan sabun, maka setelah dikeluarkan akan terbentuk lapisan air sabun pada permukaan kawat tersebut. Mirip seperti ketika dirimu bermain gelembung sabun. Karena kawat lurus bisa digerakkan dan massanya tidak terlalu besar, maka lapisan air sabun akan memberikan gaya tegangan permukaan pada kawat lurus sehingga kawat lurus bergerak ke atas (perhatikan arah panah). Untuk mempertahankan kawat lurus tidak bergerak (kawat berada dalam kesetimbangan), maka diperlukan gaya total yang arahnya ke bawah, di mana besarnya gaya total adalah F = w + T. Dalam kesetimbangan, F = gaya tegangan permukaan yang dikerjakan oleh lapisan air sabun pada kawat lurus.
Misalkan panjang kawat lurus adalah l. Karena lapisan air sabun yang menyentuh kawat lurus memiliki dua permukaan, maka gaya tegangan permukaan yang ditimbulkan oleh lapisan air sabun bekerja. Tegangan permukaan pada lapisan sabun merupakan perbandingan antara Gaya Tegangan Permukaan (F) dengan panjang permukaan di mana gaya bekerja (d). Untuk kasus ini, panjang permukaan adalah 2l.
Karena tegangan permukaan merupakan perbandingan antara Gaya tegangan permukaan dengan Satuan panjang, maka satuan tegangan permukaan adalah Newton per meter (N/m) atau dyne per centimeter (dyn/cm).
1 dyn/cm = 10-3 N/m = 1 mN/m
TERMODINAMIKA
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal.
Hukum kekekalan energi adalah salah satu dari hukum-hukum kekekalan yang meliputi energi kinetik dan energi potensial. Hukum ini adalah hukum pertama dalam termodinamika.
Asas Black adalah suatu prinsip dalam termodinamika yang dikemukakan oleh Joseph Black. Asas ini menjabarkan:
* Jika dua buah benda yang berbeda yang suhunya dicampurkan, benda yang panas memberi kalor pada benda yang dingin sehingga suhu akhirnya sama
* Jumlah kalor yang diserap benda dingin sama dengan jumlah kalor yang dilepas benda panas
* Benda yang didinginkan melepas kalor yang sama besar dengan kalor yang diserap bila dipanaskan
Rumus Asas Black =
(M1 X C1) (T1-Ta) = (M2 X C2) (Ta-T2)
Catatan :
M1 = Massa benda yang mempunyai tingkat temperatur lebih tinggi
C1 = Kalor jenis benda yang mempunyai tingkat temperatur lebih tinggi
Ta = Temperatur benda yang mempunyai tingkat temperatur lebih tinggi
T1 = Temperatur akhir pencampuran kedua benda
M2 = Massa benda yang mempunyai tingkat temperatur lebih rendah
C2 = Kalor jenis benda yang mempunyai tingkat temperatur lebih rendah
T2 = Temperatur benda yang mempunyai tingkat temperatur lebih rendah
HUKUM I TERMODINAMIKA
Hukum Kekekalan Energi (Hukum I Termodinamika) berbunyi: "Energi dapat berubah dari satu bentuk ke bentuk yang lain tapi tidak bisa diciptakan ataupun dimusnahkan (konversi energi)".
Keterangan :
delta U = Perubahan energi dalam
Q = Kalor
W = Kerja
Hukum pertama termodinamika merupakan pernyataan Hukum Kekekalan Energi dan ketepatannya telah dibuktikan melalui banyak percobaan (seperti percobaan om Jimi Joule). Perlu diketahui bahwa hukum ini dirumuskan pada abad kesembilan belas, setelah kalor dipahami sebagai energi yang berpindah akibat adanya perbedaan suhu.
HUKUM II TERMODINAMIKA
Kalor berpindah dengan sendirinya dari benda bersuhu tinggi ke benda bersuhu rendah; kalor tidak akan berpindah dengan sendirinya dari benda bersuhu rendah ke benda bersuhu tinggi (Hukum kedua termodinamika
Langganan:
Postingan (Atom)








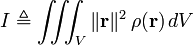

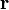 adalah jari-jari yang digunakan untuk menentukan momen inersia
adalah jari-jari yang digunakan untuk menentukan momen inersia